توضیحات
باریم کلرید (Barium Chloride) یک ترکیب یونی با فرمول مولکولی BaCl2 است که تحت عنوان باریم دی کلرید یا باریم موریات نیز شناخته می شود. در آتش شعله ای به رنگ زرد و سبز ایجاد می کند و به همین دلیل در آتش بازی ها مورد استفاده قرار می گیرد.
در این مقاله تاریخچه، خصوصیات و روش تولید این ماده را شرح می دهیم و به بررسی خطرات آن می پردازیم.
خرید باریم کلرید
برای ثبت سفارش و استعلام قیمت باریم کلرید کافیست با کارشناسان شرکت مبتکر اندیشان تماس حاصل نمایید و سفارش خود را ثبت کنید تا محصول با بهترین کیفیت و مناسب ترین قیمت در اختیار شما قرار گیرد.
تاریخچه
در سال 1898، وقتی مادام کوری در حال آزمایش بر عنصر رادیوم بود، طی آخرین واکنش جداسازی، باریم کلرید و رادیوم کلرید تشکیل شد.
خصوصیات شیمیایی و فیزیکی
این نمک سمی و بدون بو، جذب کننده رطوبت است. در جدول زیر بخشی از خصوصیات باریم کلرید به اختصار آورده شده است:
| نقطه ذوب |
963 °C |
| نقطه جوش |
1560 °C |
| چگالی |
3.856 g/mL |
| اسیدیته | 5-8 |
| دمای نگهداری |
2-8 °C |
|
انحلال پذیری در آب |
59.4 g/100ml (100 °C) |
| جرم مولکولی |
208.23 g/mol |
این ماده در آب و متانول حل می شود اما در اسید ها، اتانول، استون و اتیل استات انحلال پذیر نیست. می توان آن را به مقدار کمی در اسید نیتریک و هیدروکلریک اسید نیز حل کرد.
انحلال در آب
این ماده با انحلال در آب به یون های باریم و کلر تجزیه می شود و بر اسیدیته محلول تاثیری نمی گذارد.
BaCl2 → Ba2++ 2Cl–
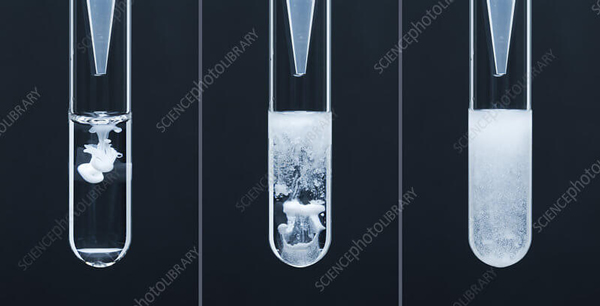
واکنش باریم کلرید با سدیم سولفات
وقتی محلول باریم کلرید با سدیم سولفات ترکیب شود، طی واکنش جایگزینی دوگانه، در انتهای لوله آزمایش رسوب سفید رنگی از سولفات باریم مشاهده می شود.
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
واکنش باریم کلرید با اسید سولفوریک
اسید سولفوریک یک اسید قوی است و به راحتی به کاتیون و آنیون تبدیل می شود و در واکنش با ترکیب یونی مورد نظر، طبق واکنش زیر به باریم سولفات و هیدروکلریک اسید تبدیل می شود.
BaCl2(s)+H2SO4(aq) → BaSO4(s)+2HCl (aq)
روش تهیه
می توان این ماده را از باریم هیدروکسید یا باریم کربنات تهیه کرد که باریم کربنات به طور طبیعی در کانی ویتریت یافت می شود. این نمک های قلیایی، باریم کلرید هیدراته تشکیل می دهند.
اما تهیه این ماده در صنعت از طریق دو مرحله صورت می گیرد:
BaSO4 + 4C → BaS + 4CO
BaS + 2HCl → BaCl2 + H2S
مرحله اول به دمای بالایی نیاز دارد. سولفات باریم همراه با کربن تا دمای بالا گرم می شود تا سولفید باریم و مونوکسید کربن تولید شود. در مرحله ی بعد، سولفید باریم تشکیل شده با کلرید هیدروژن واکنش داده و کلرید باریم را تشکیل می دهد.
باریم کلرید دو آبه
این ماده در حالت تبلور دو مولکول آب دارد و اگر آن را تا دمای 113 درجه سانتی گراد حرارت دهیم این مولکول ها را از دست می دهد و به پودر سفید رنگی تبدیل می شود.
کاربرد
باریم کلرید به دلیل خواص منحصر به فردی که دارد در طیف گسترده ای از صنایع مورد استفاده قرار می گیرد که در اینجا به بخشی از این کاربرد ها می پردازیم:
آتش بازی
در آتش بازی از این ماده برای تولید رنگ سبز استفاده می کنند.
آزمایشگاه
در آزمایشگاه ها از باریم دی کلرید به عنوان ماده خامی برای تهیه سایر نمک های باریم مانند باریم کرومات و باریم فلوئورید استفاده می شود.
از دیگر کاربرد های این ماده در آزمایشگاه می توان به تست یون سولفات نیز اشاره کرد.
نساجی
BaCl2 در تهیه رنگدانه ها کاربرد دارد.
تصفیه آب
در این صنعت، باریم کلرید به فرایند نرم کردن آب کمک می کند.
این ماده برای مقاوم سازی فلزات و تهیه تثبیت کننده های PVC نیز مورد استفاده قرار می گیرد.
MSDS و اطلاعات ایمنی
محفظه حاوی این ماده را در مکانی خشک و خنک نگهداری کنید. حین کار با آن به رعایت نکات ایمنی توجه داشته باشید و در صورت بروز هرگونه مشکل علاوه بر تماس با فوریت های پزشکی نکات زیر را به خاطر داشته باشید.
- چشم: تماس این ماده با چشم می تواند منجر به حساسیت، سوزش و اشک شود. پلک های خود را از هم باز نگه دارید و حداقل به مدت 15 دقیقه چشمانتان را با آب فراوان بشویید.
- پوست: برخورد این ماده با پوست بروز حساسیت را در پی دارد و اگر طولانی مدت به پوست مرطوب برخورد کند باعث بافت مردگی یا نکروز می شود. بنابراین، فورا لباس های آلوده را در بیاورید و محل تماس را حداقل به مدت 15 دقیقه با آب فراوان بشویید.
- بلعیدن: بلعیدن این ماده به کلیه آسیب می رساند. یون باریم منجر به تحریک عضلات و فلج شدن آنها می شود. علائم اولیه مسمومیت با این ماده حالت تهوع، ترشح بزاق و گزگز اندام ها است. فرد را وادار به استفراغ نکنید، اگر هوشیار است می تواند 2 الی 4 لیوان آب بنوشد.
- استنشاق: ممکن است علاوه بر حساسیت مجاری تنفسی، علائمی مشابه علائم حاصل از بلع این ماده ایجاد شود. بنابراین فورا محل آلوده را ترک کرده و به مکانی بروید که هوای ازاد در آن جریان داشته باشد.
این ماده با 2-فوران کربوکسیلیک اسید و برم تری فلوئورید سازگاری ندارد و نباید در معرض حرارت شدید و تجمع گرد و غبار قرار بگیرد.
جمع بندی
باریم کلرید یک نمک معدنی است که به عنوان محصول فرعی استخراج رادیوم توسط ماری کوری تهیه شد. از خواص این نمک می توان به سمیت، بدون بو و سفید رنگ و جاذب الرطوبه بودن آن اشاره کرد. از این ماده در تولید رنگ سبز آتش بازی، تست یون سولفات، تهیه سایر نمک های باریم، تولید رنگدانه در نساجی و نرم کردن آب در فرایند تصفیه استفاده کرد. اما هنگام کار با این نمک رعایت نکات ایمنی الزامی است زیرا می تواند منجر به آسیب کلیه و ریه شود.









نقد و بررسیها
هنوز بررسیای ثبت نشده است.