توضیحات
اسید سولفوریک (Sulfuric acid) یک اسید دو پروتونه و بسیار قوی است که در گذشته از آن تحت عنوان جوهر گوگرد یاد می شد. غلیرغم اینکه این اسید اکنون یکی از پر کاربرد ترین مواد شیمیایی است، تا قبل از قرن شانزدهم به ندرت مورد توجه قرار می گرفت. جان ون هلمونت با استخراج تجزیه ای زاج سبز و سوزاندن سولفور، این ماده را تهیه کرد. اما این روش بسیار هزینه بر بود بنابراین در قرن 17، جان گلوبر روش دیگری پیش گرفت و سنتز این ماده را از طریق سوزاندن سولفور به همراه پتاسیم نیترات انجام داد. از اسید سولفوریک در تهیه کود کشاورزی، فلزکاری، واکنش های شیمیایی، تصفیه آب، تهیه کاغذ، فرمولاسیون صابون و بسیاری از صنایع دیگر استفاده می شود.
در این مقاله به شرح خصوصیات، روش تهیه و کاربردهای این اسید قوی می پردازیم و نکات ایمنی که باید حین کار با آن در نظر داشته باشید را بررسی می کنیم.
خصوصیات شیمیایی و فیزیکی
اسید سولفوریک یک مایع بی رنگ یا زرد روشن است. در جدول زیر برخی از خصوصیات این ماده شیمیایی به اختصار آورده شده است:
| ساختار | 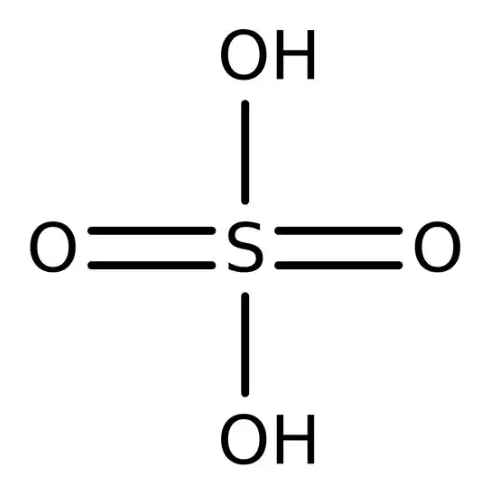 |
| فرمول شیمیایی | H2SO4 |
| وزن مولکولی | 98.079 g/mol |
| دانسیته | 1.840 g/mL |
| نقطه ذوب | 10 °C |
| نقطه جوش | 290 °C |
| نقطه اشتعال | 11 °C |
این اسید یک عامل اکسنده بسیار قوی است که واکنش پذیری زیادی دارد و می تواند بسیاری از فلزات را در خود حل کند. از دیگر ویژگی های آن می توان به جاذب الرطوبه بودن و جذب رطوبت هوا نیز اشاره کرد.
روش تهیه
این ماده به طور طبیعی از اکسیداسیون کانی های حاوی سولفید تهیه می شود. همچنین، در حضور رطوبت، اکسیداسیون سولفور دی اکسید (تهیه شده از احتراق سوخت ها) نیز منجر به تولید اسید سولفوریک رقیق می شود که آن را با عنوان باران اسیدی می شناسیم.
برای تهیه H2SO4 صنعتی روش های متعددی وجود دارد:
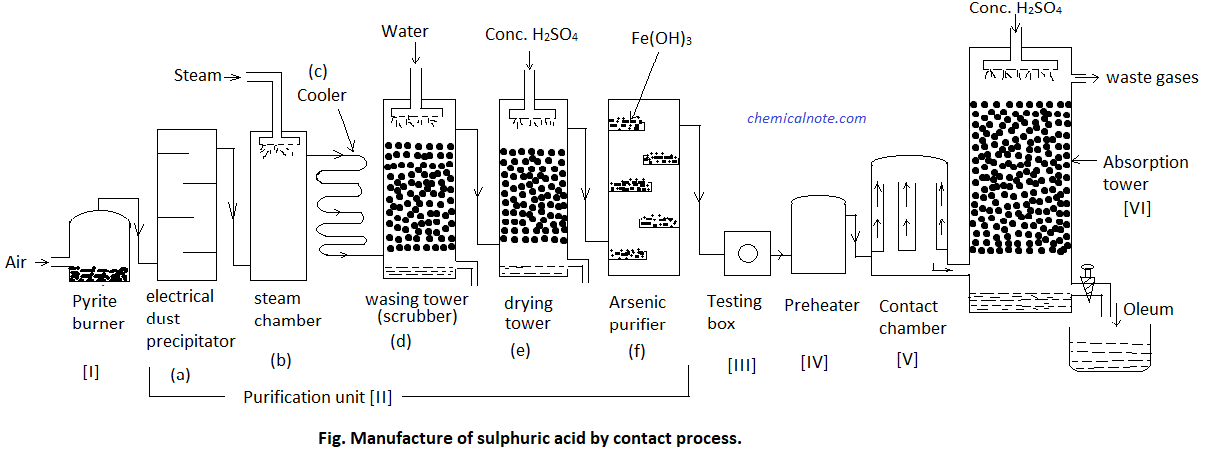
فرایند تماس (Contact Process)
این فرایند در سه مرحله انجام می شود:
- تهیه سولفور دی اسید:
می توان با سوزاندن سولفور در هوای اضافی (هوایی که بیش از مقدار مورد نیاز برای اکسایش کامل است)، طبق واکنش زیر این ماده را تهیه کرد.
S(s)+O2(g)→SO2(g)
یکی دیگر از روش های تهیه سولفور دی اکسید حرارت دادن کانی های حاوی سولفید در هوای اضافی است که طبق واکنش زیر انجام می شود:
4FeS2(s)+11O2(g)→2Fe2O3(s)+8SO2(g)
در هر دو روش از هوای اضافی استفاده می کنیم تا دی اکسید گوگرد در مرحله ی بعد با اکسیژن ترکیب شود.
- تبدیل سولفور دی اکسید به سولفور تری اکسید:
مخلوط سولفور دی اکسید و اکسیژن با حجم برابری وارد راکتور می شود.
2SO2(g)+O2(g)⇌2SO3(g)
دمای لازم برای این واکنش 400 تا 450 درجه سانتی گراد است و در فشار 1 تا 2 اتمسفر انجام می شود.
- تبدیل سولفور تری اکسید به اسید سولفوریک:
ابتدا سولفور تری اکسید در H2SO4 غلیظ حل می شود:
H2SO4(l)+SO3(g)→H2S2O7(l)
محصول این واکنش که اسید سولفوریک دود کننده یا اولئوم نامیده می شود با آب واکنش می دهد و دو برابر اسید مصرف شده، H2SO4 غلیظ تهیه می شود.
H2S2O7(l)+H2O(l)→2H2SO4
در عدم حضور کاتالیزور این واکنش بسیار آهسته انجام می شود بنابراین، می توان از پلاتین به عنوان کاتالیزگر استفاده کرد.
لازم به ذکر است که طی این فرایند اسید سولفوریک با غلظت 98% تهیه می شود.
تهیه اسید سولفوریک با فرایند اتاق سربی (Lead-chamber Process)
در این روش، با هوای مرطوب سولفور دی اکسید را اکسید می کنیم و از اکسید های نیتروژن به عنوان کاتالیزور استفاده می کنیم.
این واکنش در محفظه های بزرگ از ورقه سرب انجام می شود و می تواند جایگزین خوبی برای فرایند تماس باشد.
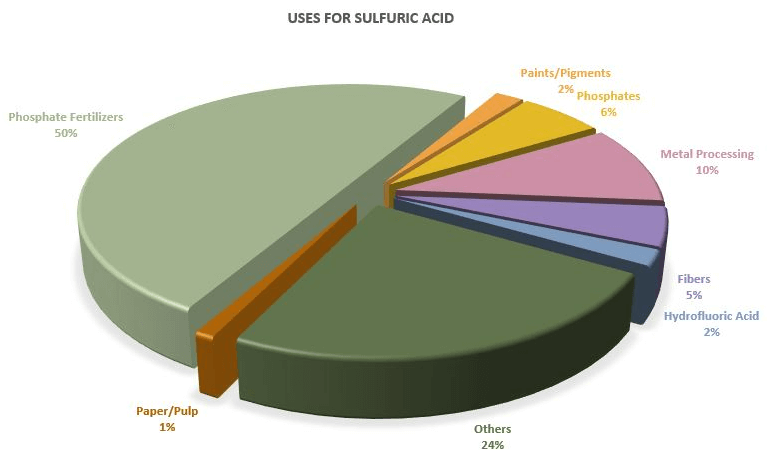
کاربرد اسید سولفوریک
H2SO4 در صنایع زیادی از جمله کشاورزی، تهیه مولاد شوینده، کاغذ، دارو، جوهر و رنگدانه مورد استفاده قرار می گیرد که در این قسمت به شرح برخی از این موارد می پردازیم:
تهیه کود های شیمیایی
بخش زیادی از H2SO4 تهیه شده به اسید فسفریک تبدیل می شود تا در تولید کود های حاوی فسفات (کلسیم دی هیدروزن فسفات و آمونیوم فسفات) از آن استفاده کنند.
مواد شوینده
اسید سولفوریک در محصولات شوینده خانگی برای سینک به کار برده می شود، همچنین صنایع تهیه آهن و فولاد از آن برای حذف زنگ زدگی استفاده می کنند.
با افزودن هیدروژن پراکسید به این ماده محلول پیرانا تشکیل می شود که به عنوان یک تمیز کننده قوی در صنعت میکروالکترونیک و تمیز کردن ظروف شیشه ای آزمایشگاه کاربرد دارد.
اسید سولفوریک در آزمایشگاه
می توان از این ماده به عنوان یک کاتالیزگز اسیدی در بسیاری از واکنش های آلی از جمله نیتروژن دار کردن بنزن و آبپوشی اتن برای تهیه اتانول استفاده کرد.
الکترولیت
این اسید قوی در باتری های اسید سرب به عنوان الکترولیت به کار می رود.
این ماده برای اصلاح نشاسته موجود در غذا و تهیه کارامل نیز مورد استفاده قرار می گیرد.
MSDS و اطلاعات ایمنی
محفظه حاوی اسید سولفوریک را در محلی خشک، خنک، با تهویه مناسب و به دور از حرارت قرار دهید. این اسید قوی با آب، فلزات، ترکیبات آلی، عوامل کاهنده قوی، مواد قابل احتراق، بازهای قوی، پیکرات، کربنات ها، سولفید ها، سیانید ها، عوامل اکسید کننده قوی و کاربید ها سازگاری ندارد.
- چشم: در صورت برخورد این ماده با چشم امکان سوختگی شدید و آسیب های غیر قابل جبرانی مانند از دست دادن بینایی وجود دارد.
- پوست: برخورد این اسید قوی با پوست می تواند سوختگی شدید ایجاد کند.
- بلعیدن: بلع این ماده می تواند باعث آسیب و سوختگی دستگاه گوارش شود.
- استنشاق: تنفس بخارات این اسید درد و سوزش بینی و گلو، خس خس قفسه سینه، تنگی نفس و آدام ریوی را به همراه دارد و می تواند به مجاری تنفسی آسیب بزند.
قرار گرفتن در معرض بخارات اسید های معدنی حاوی H2SO4 خطر سرطان را به همراه دارد.
جمع بندی
اسید سولفوریک یک اسید قوی است که خاصیت خورندگی و واکنش پذیری زیادی دارد. در قرن شانزدهم شیمی دانی به نام جان ون هلمونت با استخراج تجزیه ای زاج سبز و سوزاندن سولفور، این ماده را تهیه کرد و طی سال ها روش های مختلفی برای تولید کم هزینه تر و پر بازده تر این اسید بوجود آمد. بخش زیادی از H2SO4 مورد نیاز از فرایند تماس و فرایند اتاق سربی تهیه می شود و از این اسید در تهیه کود های شیمیایی، ترکیبات دارویی، مواد شوینده و صنایع غذایی مورد استفاده قرار می گیرد. با این وجود هنگام کار با این ماده باید احتیاط کرد زیرا خطر آسیب شدید به چشم، پوست، دستگاه تنفس، دستگاه گوارش و حتی سرطان را به همراه دارد.










نقد و بررسیها
هنوز بررسیای ثبت نشده است.